اسپارتینا®: اثربخشی اثباتشده در کاهش وزن بزرگسالان مبتلا به چاقی یا اضافهوزن


این تصویر صرفاً برای اهداف نمایشی است.
کاهش وزن اثباتشده بالینی با تیرزپاتاید
در کارآزمایی ۷۲ هفتهای SURMOUNT-1، تیرزپاتاید ۱۵ میلیگرم، کاهش وزنی حدود ۷ برابر بیشتر از پلاسبو ایجاد کرد.
بهطور میانگین، بزرگسالان
20.9%
از وزن خود را با دوز ۱۵ میلیگرم تیرزپاتاید کاهش دادند. درحالیکه در گروه پلاسبو این میزان 3.1% بود.
تغییر درصد وزن بدن نسبت به پایه در هفته ۷۲ با تیرزپاتاید
15.0%-
(15.4- کیلوگرم)
تیرزپاتاید ۵ میلیگرم
(n=630)
با میانگین وزن پایه 102.9 کیلوگرم
19.5%-
(20.1- کیلوگرم)
تیرزپاتاید ۱۰ میلیگرم
(n=636)
با میانگین وزن پایه 105.8 کیلوگرم
20.9%-
(21.8- کیلوگرم)
تیرزپاتاید ۱۵ میلیگرم
(n=630)
با میانگین وزن پایه 105.6 کیلوگرم
3.1%-
(2.9- کیلوگرم)
پلاسبو
(n=643)
با میانگین وزن پایه 104.8 کیلوگرم
نمایش تغییر درصد وزن بدن نسبت به پایه در کارآزمایی SURMOUNT-1 (تیرزپاتاید ۵، ۱۰ و ۱۵ میلیگرم در مقابل پلاسبو در هفته ۷۲)
این تصویر میانگین تغییر درصد وزن بدن را نسبت به پایه پس از ۷۲ هفته برای چهار گروه نشان میدهد:
- تیرزپاتاید ۵ میلیگرم: 15.0٪ کاهش وزن
- تیرزپاتاید ۱۰ میلیگرم: 19.5٪ کاهش وزن
- تیرزپاتاید ۱۵ میلیگرم: 20.9٪ کاهش وزن
- پلاسبو: 3.1٪ کاهش وزن
اطلاعات تکمیلی
- تعداد شرکتکنندگان در هر گروه حدود ۶۳۰ تا ۶۴۳ نفر بود.
- میانگین وزن پایه تمام شرکتکنندگان تقریباً ۱۰۵ کیلوگرم بود.
- این نتایج بر کاهش وزن بیشتر با افزایش دوز تأکید دارد؛ دوزهای بالاتر تیرزپاتاید کاهش درصد بیشتری را نشان دادند.
رویکرد جامع برای مدیریت اضافهوزن و چاقی
مدیریت وزن باید براساس شرایط فردی هر بیمار انجام شود و نباید از رویکرد درمانی یکسانی برای همه استفاده کرد. شدت درمان نیز باید با شدت عوارض ناشی از چاقی متناسب باشد.
مراقبت مبتنی بر شواهد در درمان چاقی با اصلاح سبک زندگی متناسب با هر فرد، شامل رژیم غذایی، فعالیت بدنی و رفتاردرمانی، آغاز میشود و درصورت نیاز، درمانهای دارویی به آن افزوده میشود.
مکانیسم عمل
اسپارتینا® (تیرزپاتاید) یک آگونیست دوگانه گیرندههای پپتید انسولینوتروپیک وابسته به گلوکز (GIP) و پپتید شبه گلوکاگون-۱ (GLP-1) است. این اثر دوگانه با هدف کنترل همزمان قند خون و مدیریت وزن طراحی شده است.
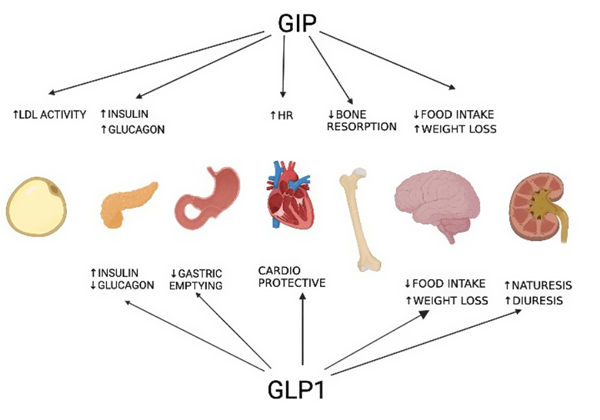
در زمینه مدیریت وزن، اسپارتینا® از چند مسیر عمل میکند:
- کنترل اشتها: اسپارتینا® با فعالسازی گیرندههای GLP-1 و GIP مرتبط با احساس سیری، باعث کاهش گرسنگی و دریافت کالری میشود.
- کند شدن تخلیه معده: اسپارتینا® با آهستهتر کردن سرعت تخلیه معده، احساس سیری طولانیتری ایجاد میکند که باعث کاهش حجم و تعداد وعدههای غذایی میشود.
- تنظیم تعادل انرژی: اسپارتینا® با اثرگذاری بر مسیرهای سیستم عصبی مرکزی تنظیمکننده دریافت غذا و مصرف انرژی، به کاهش وزن کمک میکند.
- کاهش توده چربی: شواهد بالینی نشان دادهاند تیرزپاتاید وزن بدن را عمدتاً از طریق کاهش توده چربی و درعینحال حفظ توده عضلانی کاهش میدهد.
اثربخشی اثباتشده در مدیریت وزن
تیرزپاتاید نوعی آگونیست دوگانه گیرندههای GIP و GLP-1 است که برای مدیریت وزن مزمن در بزرگسالان مبتلا به چاقی (BMI ≥ 30 کیلوگرم بر مترمربع) یا اضافهوزن (BMI ≥ 27 کیلوگرم بر مترمربع) که حداقل یک بیماری مرتبط با وزن دارند (مانند فشارخون بالا، دیسلیپیدمی یا دیابت نوع ۲)، همراه با رژیم کمکالری و افزایش فعالیت بدنی تأیید شده است. در پنج کارآزمایی SURMOUNT، تیرزپاتاید کاهش وزن قابل توجه آماری و بالینی ایجاد کرد.
کاهش وزن در بزرگسالان بدون دیابت نوع ۲
در کارآزمایی SURMOUNT-1، درمان یک بار در هفته با تیرزپاتاید پس از ۷۲ هفته، نسبت به پلاسبو کاهش وزن معنیدار و پایداری ایجاد کرد.
درصد بیماران با کاهش وزن ≥ ۵٪ در هفته ۷۲:
- تیرزپاتاید ۱۵ میلیگرم : 90.9%
- تیرزپاتاید ۱۰ میلیگرم : 88.9%
- تیرزپاتاید ۵ میلیگرم : 85.1%
- پلاسبو : 34.5%
کاهش وزن در بزرگسالان مبتلا به دیابت نوع ۲
در کارآزمایی SURMOUNT-2، درمان ۷۲ هفتهای با تیرزپاتاید باعث کاهش وزن قابل توجه بالینی در مبتلایان به دیابت نوع 2 شد.
درصد بیماران با کاهش وزن ≥ ۵٪ در هفته ۷۲:
- تیرزپاتاید ۱۵ میلیگرم : 86.4%
- تیرزپاتاید ۱۰ میلیگرم : 81.6%
- پلاسبو : 30.6%
در مطالعه SURMOUNT-1، ۵۰.۱ ٪ از بیماران دریافتکننده تیرزپاتاید ۱۰ میلیگرم و 56.7 ٪ از بیماران دریافتکننده تیرزپاتاید ۱۵ میلیگرم، در هفته ۷۲ بیشتر/ مساوی 20% از وزن اولیه خود را کاهش دادند.
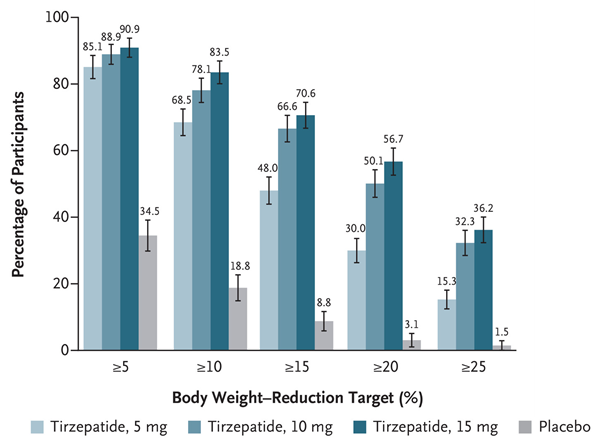
تیرزپاتاید در تمام شاخصهای اندازهگیریشده، در کاهش وزن به صورت معنیداری اثربخشی بالاتری نسبت به پلاسبو نشان داد.
همچنین رابطه آشکاری میان دوز و پاسخ درمانی دیده میشود؛ بهطوریکه دوزهای بالاترِ تیرزپاتاید با درصد بیشتری از شرکتکنندگان که کاهش وزن قابلتوجهتری داشتند همراه بود.
دادهها بهروشنی نشان میدهند که تیرزپاتاید در کاهش وزن بسیار مؤثر است و اثربخشی آن با افزایش دوز بیشتر میشود. تمام گروههای دوز تیرزپاتاید در همه سطوح کاهش وزن، عملکردی بهمراتب بهتر از پلاسبو داشتند که پتانسیل این دارو را بهعنوان گزینهای مؤثر برای مدیریت وزن نشان میدهد. شایان ذکر است که در دوزهای بالاتر تیرزپاتاید، درصد قابل توجهی از شرکتکنندگان به کاهش وزن بالینی چشمگیر ۲۰٪ یا بیشتر دست یافتند.
بهبود شاخصهای کاردیومتابولیک با تیرزپاتاید
تریگلیسیرید
سطح پایه تیرزپاتاید= 127.5 mg/dL
سطح پایه پلاسبو = 130.8 mg/dL
5.6%- گروه پلاسبو
کلسترول LDL
سطح پایه تیرزپاتاید= 110.1 mg/dL
سطح پایه پلاسبو = 109.4 mg/dL
1.7%- گروه پلاسبو
کلسترول HDL
سطح پایه تیرزپاتاید= 47.6 mg/dL
سطح پایه پلاسبو = 46.6 mg/dL
0.7%- گروه پلاسبو
فشارخون دیاستولیک
سطح پایه تیرزپاتاید= 79.5 mm Hg
سطح پایه پلاسبو = 79.6 mm Hg
0.8- mm Hg گروه پلاسبو
فشارخون سیستولیک
سطح پایه تیرزپاتاید= 123.5 mm Hg
سطح پایه پلاسبو = 122.9 mm Hg
1.0- mm Hg گروه پلاسبو
مقایسه مستقیم تیرزپاتاید با سماگلوتاید
در کارآزمایی SURMOUNT-5 که به صورت مستقیم اثر تیرزپاتاید را با سماگلوتاید مقایسه کرد، تیرزپاتاید در طول ۷۲ هفته به صورت معنیداری کاهش وزن بیشتری ایجاد کرد (میانگین تغییر 20.2-% در مقابل 13.7-%).
این دادهها نشان میدهند تیرزپاتاید میتواند نسبت به سماگلوتاید در مدیریت وزن در بزرگسالان مبتلا به چاقی اثربخشی بیشتری داشته باشد.
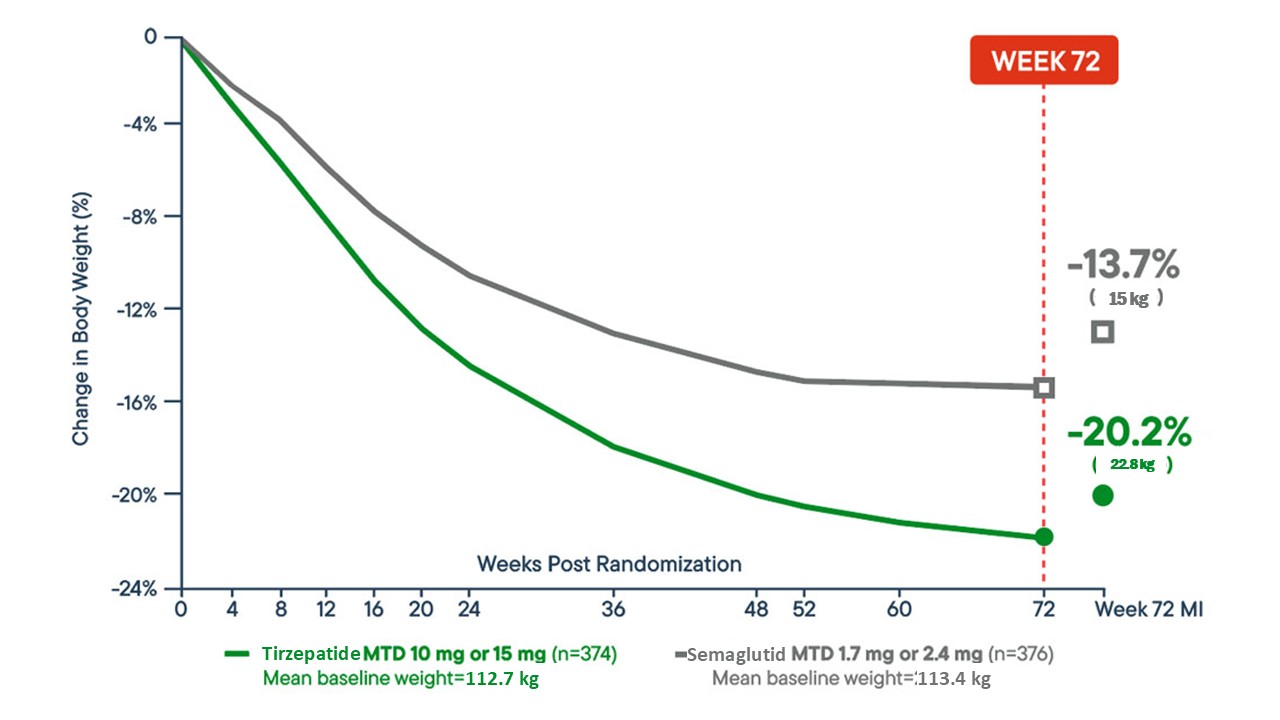
تغییر درصد وزن بدن: تیرزپاتاید در مقایسه با سماگلوتاید در هفته ۷۲
نمودار خطی از کارآزمایی SURMOUNT-5، تغییر درصد وزن بدن از سطح پایه تا هفته ۷۲ را نشان میدهد:
تیرزپاتاید با حداکثر دوز قابل تحمل (۱۰ میلیگرم یا ۱۵ میلیگرم)
- تعداد شرکتکنندگان: 374 بزرگسال
- میانگین تغییر درصد: 20.2–%
- میانگین کاهش وزن: 22.8- کیلوگرم
سماگلوتاید با حداکثر دوز قابل تحمل (1.7 میلیگرم یا 2.4 میلیگرم)
- تعداد شرکتکنندگان: 376 بزرگسال
- میانگین تغییر درصد: 13.7–%
- میانگین کاهش وزن: معادل 15.0- کیلوگرم
این مقایسه مستقیم نشان میدهد تیرزپاتاید طی ۷۲ هفته کاهش وزن کلی بیشتری نسبت به سماگلوتاید ایجاد میکند.
دوز مصرف و نحوه تجویز
دوز شروع: ۲.۵ میلیگرم زیرجلدی، یک بار در هفته بهمدت ۴ هفته
افزایش دوز: هر ۴ هفته، با توجه به تحمل بیمار و پاسخ بالینی، مقدار دوز را به میزان 2.5 میلیگرم افزایش دهید.
توجه: دوز ۲.۵ میلیگرم فقط برای شروع درمان است و دوز نگهدارنده نیست.
دوز نگهدارنده را بر اساس پاسخ بالینی و تحمل بیمار انتخاب کنید.
حداکثر دوز: ۱۵ میلیگرم در هفته
باید بهصورت زیرجلدی، یک بار در هفته، در ناحیه شکم، ران یا بازو تزریق شود.
Select Important Safety Information
Spartina (tirzepatide) is contraindicated in patients with a personal or family history of medullary thyroid carcinoma (MTC), as well as in those with Multiple Endocrine Neoplasia syndrome type 2 (MEN 2). It is also contraindicated in patients with known serious hypersensitivity to tirzepatide or any of its excipients. Serious hypersensitivity reactions, including anaphylaxis and angioedema, have been reported with tirzepatide use. Healthcare professionals should evaluate patient history thoroughly before prescribing Spartina and provide appropriate counseling regarding potential symptoms of hypersensitivity reactions.
Patients should be counseled about the potential risk for medullary thyroid carcinoma (MTC) when using Spartina (tirzepatide) and should be informed about symptoms that may indicate thyroid tumors, such as a mass in the neck, difficulty swallowing, shortness of breath, or persistent hoarseness. Routine monitoring of serum calcitonin levels or thyroid ultrasound is not routinely recommended, as these methods have uncertain value for early MTC detection. Such monitoring may lead to unnecessary procedures due to low test specificity and the high background incidence of thyroid disease. Significantly elevated serum calcitonin values, typically above 50 ng/L, may indicate MTC and require further evaluation. Patients presenting with thyroid nodules upon physical examination or imaging should also undergo appropriate diagnostic assessment.
The use of Spartina (tirzepatide) has been associated with gastrointestinal adverse reactions, including events that may be severe. In a pooled analysis from two clinical trials (SURMOUNT-1 and SURMOUNT-2), severe gastrointestinal adverse reactions were reported more frequently in patients receiving Spartina compared to placebo. Specifically, severe gastrointestinal adverse reactions occurred in 1.7% of patients receiving 5 mg, 2.5% of patients receiving 10 mg, and 3.1% of patients receiving 15 mg, versus 1.0% in patients receiving placebo. Comparable rates of severe gastrointestinal adverse reactions were observed in clinical trials evaluating Spartina for weight reduction and for obstructive sleep apnea. Spartina has not been studied in patients with severe gastrointestinal diseases, including severe gastroparesis, and is therefore not recommended for use in these patients.
The use of Spartina (tirzepatide) has been associated with acute kidney injury, which may occur as a result of dehydration linked to gastrointestinal adverse reactions such as nausea, vomiting, and diarrhea. Postmarketing reports from patients treated with GLP-1 receptor agonists have included cases of acute kidney injury and worsening of chronic renal failure, some of which required hemodialysis. These events have been documented even in patients without previously known renal disease. In most reported cases, acute kidney injury occurred in the context of gastrointestinal symptoms leading to volume depletion. Renal function should be monitored in patients receiving Spartina, particularly if they report adverse reactions that could increase the risk of dehydration.
Ask ChatGPT
Treatment with Spartina (tirzepatide) is associated with an increased occurrence of acute gallbladder disease. In pooled data from two clinical trials (SURMOUNT-1 and SURMOUNT-2), cholelithiasis was reported in 1.1% of patients treated with Spartina compared to 1.0% of those receiving placebo. Cholecystitis occurred in 0.7% of Spartina-treated patients versus 0.2% of placebo-treated patients, and cholecystectomy was reported in 0.2% of Spartina-treated patients, with no cases reported in the placebo group. Acute gallbladder events were observed in association with weight reduction, and similar rates of cholelithiasis were documented in clinical trials evaluating Spartina for both weight reduction and obstructive sleep apnea. If cholecystitis is suspected during treatment, gallbladder diagnostic studies and appropriate clinical follow-up are recommended.
Use of Spartina (tirzepatide) has been associated with gastrointestinal adverse reactions, including events that may be severe. In a pooled analysis of two clinical trials (SURMOUNT-1 and SURMOUNT-2), severe gastrointestinal adverse reactions occurred more frequently in patients treated with Spartina compared to those receiving placebo. Specifically, severe gastrointestinal adverse reactions were reported in 1.7% of patients receiving 5 mg, 2.5% of patients receiving 10 mg, and 3.1% of patients receiving 15 mg of Spartina, compared to 1.0% of patients in the placebo group. Comparable rates of severe gastrointestinal adverse reactions were observed in clinical trials evaluating Spartina for weight reduction and for obstructive sleep apnea. Spartina has not been studied in patients with severe gastrointestinal diseases, including severe gastroparesis, and its use is not recommended in these individuals.
منابع:
– Tirzepatide – Prescribing information
– Jastreboff AM, Aronne LJ, Ahmad NN, et al. Tirzepatide once weekly for the treatment of obesity. N Engl J Med. 2022;387(3):205-216. doi:10.1056/NEJMoa2206038
– Garvey WT, Fras JP, Jastreboff AM, et al. Tirzepatide once weekly for the treatment of obesity in people with type 2 diabetes (SURMOUNT 2) a double blind, randomised, multicentre, placebo controlled, phase 3 trial. Lancet. 2023402(10402):613-626, doi:10.1016/50140-6736(23)01200-X
– Aronne LJ, Bade Horn D, le Roux CW, et al. Tirzepatide as compared with semaglutide for the treatment of obesity. N Engl J Med. 2025;Epub1-58. doi:10.1056/NEJMoa2416394
